独自の創薬ビジネス
[卓越した新薬開発力と自社販売・流通力]
シンバイオ製薬では、ライセンス取得からわずか5年で抗がん剤「トレアキシン®」の承認を取得し、販売を開始しました。一般的に9年~16年ともいわれる新薬開発期間に比べ、圧倒的なスピードであり、独自の新薬開発モデルの非常に高い成功確率を物語っています。この開発モデルがもつ7つの優位性をお示しします。
新薬開発から承認取得、そして販売・流通までのすべてを担うシンバイオ独自の創薬ビジネス
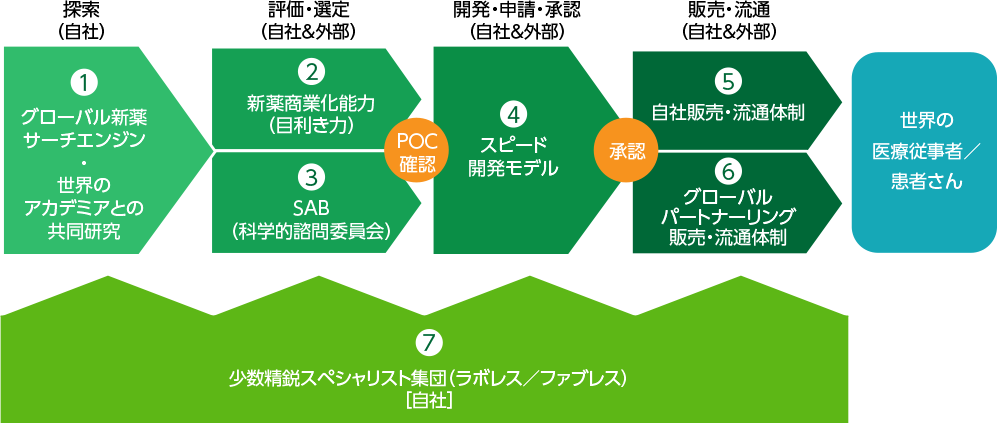
① グローバル新薬サーチエンジン
世界中の製薬企業やバイオベンチャー、大学研究機関等に直結したネットワークを構築。常に世界の研究をモニタリングしながら新薬候補品の探索を行い、その膨大な情報から新薬候補品を厳選、導入しています。
② 豊富な経験と実績による目利き力
世界中から探索された有望な新薬候補品の情報に対し、当社のトップや開発担当者が直接出向いてディスカッションを重ね、経験と実績に裏付けられた「目利き力」によって製品化の可能性を見極めます。一般に臨床試験に入った新薬候補品が承認に至る確率は13分の1ほどとされていますが、当社では探索における優れた目利き力により高確率での新薬承認を目指しています。
③ 世界の頭脳が集結した科学的諮問委員会(SAB)
シンバイオ製薬では、優れた実績と経験を有する世界中の臨床医や基礎科学者などによる「科学的諮問委員会=サイエンティフィック・アドバイザリー・ボード」、通称「SAB(エス・エー・ビー)」を組織しています。SABでは有望な新薬候補について、医療ニーズの高さや収益性等について徹底的に議論を重ね、厳正に評価します。
④ レイトステージ戦略を軸にしたスピード開発モデル
一般的に新薬開発は、基礎研究、前臨床試験、臨床試験と何段階ものプロセスが必要で、9~16年の期間を費やします。これに対して当社は基礎研究を一切行わず、“レイトステージ”と呼ばれる既にヒトでの効果・安全性が確認された後期段階を中心に、たとえ前臨床試験の前段階でも複数のデータや論文等からヒトでの効果と安全性が期待できる新薬候補品を導入し、承認までの時間を大幅に短縮しています。この戦略により、4~6年以内という最短のタイムラインでの新薬承認を実現しています。
⑤ 自社販売・流通体制
卓越した新薬開発力に加え、当社の創薬ビジネスを支えるもう一つの特長が、トレアキシン®において2020年12月に開始したコンパクトで専門性の高い自社販売・流通体制です。
○トレアキシン®専門MRによる情報提供と提案力
営業組織の最大の特長は、高度な専門性です。血液がん専門医と強い信頼関係をもつ「ヘマトロジーエキスパート」と、全国に配置された血液がん専門MR「トレアキシンマネージャー」が連携。ドクターや医療従事者への最新知見の情報提供や提案を実践しています。
○タイムリーかつ確実にお届けする全国流通体制
円滑な安定供給のために、スズケングループと共創未来グループの2社を総代理店とする全国流通体制を構築。さらにエス・ディ・コラボとの協働による東日本と西日本にある2か所の物流拠点では、厳格な品質管理のもと、全国の医療機関へ迅速にお届けしています。
⑥ グローバルパートナーリング販売・流通体制
グローバル戦略製品「ブリンシドホビル」は、ウイルス感染症だけでなく、血液・がん領域、脳神経疾患領域など、多様な疾患領域に期待され、現在世界各国で臨床開発を進めています。今後開発状況に合わせて、自社による販売・流通体制に加えて、地域市場特性に合わせたグローバルパートナーリングによる販売・流通体制を整備する計画です。
⑦ 少数精鋭の専門家集団
シンバイオ製薬は少数精鋭の専門家のみで構成されたラボレス/ファブレス(研究・生産設備を持たない)企業です。外部企業とのコラボレーションによる低コスト開発体制を構築し、機動力の高い経営を実践しています。
